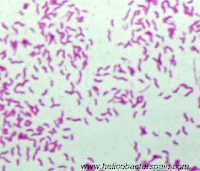
TINCION DE GRAM
Protocolo
Recoger muestras
Hacer el extendido en espiral
Dejar secar a temperatura ambiente
Fijar la muestra con metanol durante un minuto o al calor (flameado 3 veces aprox.)
Agregar azul violeta (cristal violeta o violeta de genciana) y esperar 1 min. Este tinte (al final del procedimiento) dejará de color morado solo a las bacterias Gram positivas.
Enjuagar con agua.
Agregar lugol y esperar 30 segundos
Enjuagar con agua.
Agregar alcohol acetona y esperar 15 s
Enjuagar con agua.
Agregar safranina y esperar 1 min. Este tinte dejará de color rosado las bacterias Gram negativas.
Enjuagar con agua.
Para observar al microscopio óptico es conveniente hacerlo a 100x con aceite de inmersión
Explicación
El cristal violeta (colorante catiónico) penetra en todas las células bacterianas (tanto Gram positivas como Gram negativas).
El lugol está formado por I2 (yodo) en equilibrio con KI (yoduro de potasio), el cual está presente para solubilizar el yodo. El I2 entra en las células y forma un complejo insoluble en solución acuosa con el cristal violeta.
La mezcla de alcohol-acetona que se agrega, sirve para realizar la decoloración, ya que en la misma es soluble el complejo I2/cristal violeta. Los organismos Gram positivos no se decoloran, mientras que los Gram negativos sí lo hacen.
Para poner de manifiesto las células Gram negativas se utiliza una coloración de contraste. Habitualmente es un colorante de color rojo, como la safranina o la fucsina. Después de la coloración de contraste las células Gram negativas son rojas, mientras que las Gram positivas permanecen azules.
La safranina puede o no utilizarse, no es crucial para la técnica. Sirve para hacer una tinción de contraste que pone de manifiesto las bacterias Gram negativas. Al término del protocolo, las Gram positivas se verán azul-violáceas y las Gram negativas, se verán rosas (si no se hizo la tinción de contraste) o rojas (si se usó, por ejemplo, safranina)
Esta importante coloración diferencial fue descubierta por Hans Christian Gram en 1884. En este método de tinción, la extensión bacteriana se cubre con solución de uno de los colorantes de violeta de metilo, que se deja actuar durante un lapso determinado. Se escurre luego el exceso de violeta de metilo y se añade luego una solución de yodo, que se deja durante el mismo tiempo que la anterior; después se lava el portaobjetos con alcohol hasta que éste no arrastre más colorante. Sigue a tal tratamiento una coloración de contraste, como safranina, fucsina fenicada diluida, pardo Bismarck, pironin B o hasta inclusive verde de malaquita.
Algunos microorganismos retienen el colorante violeta, aún después de tratarlos con un decolorante, y el color no se modifica al añadir éste; otros pierden con facilidad el primer tinte, y toman el segundo.
Los que fijan el violeta, se califican de grampositivos, y los que pierden la primera coloración y retienen la segunda, de gramnegativos. Basándonos pues, en la reacción Gram, podemos clasificar a los microorganismos en uno de los dos grupos.
Los colorantes de p-rosanilina son los que mejores resultados dan en la coloración Gram. Los representantes más usados de este grupo son violeta de metilo y violeta cristal o de genciana. En realidad, violeta de metilo es el nombre atribuido al compuesto tetrametil-p-rosanilina.
El matiz de color de la p-rosanilina se intensifica al aumentar el número de grupos metilo en la molécula; por consiguiente, de los tres grupos, el tono más oscuro es la hexametil-p-rosanilina (violeta cristal), y el tinte más ligero, la tetrametil-p-rosanilina (violeta de metilo). Los nombres violeta de metilo 3R, 2R, R, B, 2B, 3B, etc., se refieren al número de grupos metilo contenido. La letra R indica matices rojos, y la letra B, tonos azules. El violeta de cristal contiene seis grupos metilo, y se considera como el mejor colorante primario para teñir por el método de Gram.
La facultad de las células para tomar la coloración Gram no es propia de toda sustancia viviente, sino que se limita casi en absoluto a hongos y bacterias. Así vemos que las células de plantas y animales superiores no conservan la primera coloración; los mohos se tiñen con cierta irregularidad; los gránulos de micelios propenden retener el colorante. La reacción de Gram no es infalible ni constante; puede variar con el tiempo del cultivo y el pH del medio, y quizá por otras causas.
Técnica de la coloración gram
Fijar un frotis
Con la ayuda de un mechero, flamear un asa bacteriológica y esperar que enfríe un poco.
Tomar el asa (previamente flameada) y con ésta tomar un poco de muestra.
Una vez obtenida una pequeña cantidad de la muestra (con el asa), hacer que ésta tenga contacto con una lámina portaobjetos, la cual servirá para depositar la muestra contenida en el asa.
Con el asa (conteniendo la muestra) sobre la lámina portaobjetos, proceder a realizar la extensión de la muestra en el portaobjetos mediante movimientos giratorios (dar vueltas con el asa) sobre la lámina, de tal forma que al terminar la extensión, tengamos como producto una espiral en la parte media de la lámina.
Esperar que seque al aire libre o ayudarse con la llama de un mechero para fijar la muestra, teniendo en cuenta que el calor no debe ser directo (sólo se pasa por la llama), puesto que el calor excesivo puede cambiar la morfología celular de las bacterias a observar. El calor deseable es aquél en el que el portaobjetos sea apenas demasiado caliente para ser colocado sobre el dorso de la mano.
Tinción
Con violeta cristal o violeta de genciana, utilizando una cantidad suficiente de dicho colorante sobre la muestra, como para lograr cubrirla por completo. Se deja actuar al colorante por 1 minuto. Esta tinción de 1 minuto está dada para trabajar a una temperatura ambiente de 25 ºC.
Enjuague
Al transcurrir el minuto, se debe enjuagar la lámina conteniendo la muestra con agua corriente. Para realizar el lavado, se debe tener en cuenta que el chorro de agua NO debe caer directamente sobre la muestra, ésta debe caer sobre la parte superior de la lámina que no contiene muestra. El chorro debe ser un chorro delgado, aproximadamente de medio a un centímetro de espesor. También el enjuague se debe realizar poniendo la lámina en posición inclinada hacia abajo...
Mordiente
Una vez enjuagado el portaobjetos, se aplica como mordiente yodo o lugol durante 1 minuto más.
El mordiente es cualquier sustancia que forme compuestos insolubles con colorantes y determine su fijación a las bacterias
Decoloración
Pasado el minuto de haber actuado el mordiente, el frotis se decolora con etanol al 75 %, etanol al 95 %, acetona o alcohol-acetona, hasta que ya no escurra más líquido azul. Para esto se utiliza el gotero del frasco del decolorante. Se van añadiendo cantidades suficientes del decolorante, hasta lograr que éste salga totalmente transparente, es decir, hasta que ya no escurra más líquido azul
Lavado y secado
Lavar con agua para quitar los residuos de decolorante y esperar que seque la lámina al aire libre o con la ayuda de la llama de un mechero de la forma anteriormente descrita.
Tinción de contraste
Una vez que la lámina ya secó, procedemos a teñir nuevamente, pero esta vez se va a utilizar un colorante de contraste como por ejemplo la safranina, dejar actuar durante 1 minuto.
Nuevo enjuague
Pasado el minuto correspondiente, se procede a enjuagar la lámina con agua, se escurre el agua sobrante y se seca en la forma anteriormente descrita.
De esta manera, ya tendremos listo el frotis para su respectiva observación microscópica.
Bacterias resistentes a la tinción Gram
La siguientes bacterias de naturaleza grampositiva, tiñen como gramnegativas:
Mycobacterias (están encapsuladas)
Mycoplasmas (no tienen pared)
Formas L (pérdida ocasional de la pared)
Protoplastos y esferoplastos (eliminación total y parcial de la pared, respectivamente)
Utilidades
En el análisis de muestras clínicas suele ser un estudio fundamental por cumplir varias funciones:
Identificación preliminar de la bacteria causal de la infección.
Utilidad como control calidad del aislamiento bacteriano. Los morfotipos bacterianos identificados en la tinción de Gram se deben de corresponder con aislamientos bacterianos realizados en los cultivos. Si se observan mayor número de formas bacterianas que las aisladas hay que reconsiderar los medios de cultivos empleados así como la atmósfera de incubación.
A partir de la tinción de Gram pueden distinguirse varios morfotipos distintos: Los cocos son de forma esférica. Pueden aparecer aislados después de la división celular (Micrococos), aparecer por pares (Diplococos), formar cadenas (Estreptococos), o agruparse de manera irregular (Estafilococos).
Los bacilos poseen forma alargada. En general suelen agruparse en forma de cadena (Estreptobacilos) o en empalizada.
También pueden distinguirse los espirales, que se clasifican en espirilos si son de forma rígida o espiroquetas si son blandas y onduladas. Si por el contrario, poseen forma de "coma", o curvados, entonces se los designa vibriones.
Fundamentos de diferenciación de Gram positivo y Gram negativo
Los fundamentos de la técnica se basan en las diferencias entre las paredes celulares de las bacterias Gram positivas y Gram negativas
La pared celular de las bacterias Gram positivas posee una gruesa capa de peptidoglucano, además de dos clases de ácidos teicoicos: Anclado en la cara interna de la pared celular y unido a la membrana plasmática, se encuentra el ácido lipoteicoico, y más en la superficie, el ácido teicoico que está anclado solamente en el peptidoglucano (también conocido como mureína)
Por el contrario, la capa de peptidoglucano de las Gram negativas es delgada, y se encuentra unida a una segunda membrana plasmática exterior (de composición distinta a la interna) por medio de lipoproteínas. Tiene una capa delgada de peptidoglicano unida a una membrana exterior por lipoproteínas. La membrana exterior está hecha de proteína, fosfolípido y lipopolisacárido.
Por lo tanto, ambos tipos de bacterias se tiñen diferencialmente debido a estas diferencias constitutivas de su pared. La clave es el peptidoglicano, ya que es el material que confiere su rigidez a la pared celular bacteriana, y las Gram positivas lo poseen en mucha mayor proporción que las Gram negativas.
La diferencia que se observa en la resistencia a la decoloración, se debe a que la membrana externa de las Gram negativas es soluble en solventes orgánicos, como por ejemplo la mezcla de alcohol/acetona. La capa de peptidoglucano que posee es demasiado delgada como para poder retener el complejo de cristal violeta/yodo que se formó previamente, y por lo tanto este complejo se escapa, perdiéndose la coloración azul-violácea. Pero por el contrario, las Gram positivas, al poseer una pared celular más resistente y con mayor proporción de peptidoglicanos, no son susceptibles a la acción del solvente orgánico, sino que este actúa deshidratando los poros cerrándolos, lo que impide que pueda escaparse el complejo cristal violeta/yodo, y manteniendo la coloración azul-violácea.
Causas que alteran la tinción de Gram
I: Edad de la bacteria.
II: Errores del operador.
III: Uso de antibióticos